
利用CRISPR-Cas9技術進行(xíng)癌症治療一(yī)直受到腫瘤編輯效率低(dī)和(hé)現有(yǒu)傳遞系統潛在毒性的(de)阻礙。
今天我們來讨論一(yī)種安全有(yǒu)效的(de)脂質納米顆粒(LNP),它使用一(yī)種新型的(de)氨基電離(lí)脂質來傳遞Cas9 mRNA和(hé)sgRNAs。單次腦內(nèi)注射針對PLK1的(de)CRISPR-LNPs (sgPLK1-cLNPs)到侵襲性原位膠質母細胞瘤中,可(kě)使體內(nèi)高(gāo)達70%的(de)基因編輯,導緻腫瘤細胞凋亡,抑制腫瘤生長(cháng)50%,提高(gāo)30%的(de)存活率。為(wèi)了達到彌散性腫瘤,cLNPs也被設計為(wèi)抗體靶向輸送。腹腔注射靶向egfr的(de)sgPLK1-cLNPs可(kě)使其選擇性攝取到播散性卵巢腫瘤中,可(kě)使體內(nèi)高(gāo)達80%的(de)基因編輯,抑制腫瘤生長(cháng),提高(gāo)80%的(de)存活率。
破壞腫瘤體內(nèi)基因表達的(de)能力為(wèi)癌症治療、研究和(hé)非癌組織靶向基因編輯的(de)潛在應用開辟了新的(de)途徑。
近年(nián)來,分子(zǐ)靶向抑制劑和(hé)免疫治療大大改善了腫瘤反應,減少了毒性和(hé)不良反應。然而,大多數類型癌症的(de)高(gāo)複發率和(hé)耐藥性的(de)發展突出了對新的(de)治療方式的(de)需要。大多數癌症藥物需要反複給藥,這增加了治療相關的(de)毒性和(hé)治療成本,嚴重降低(dī)了患者的(de)生活質量。

CRISPR- Cas9基因編輯具有(yǒu)永久破壞腫瘤生存基因的(de)潛力,它可(kě)以克服傳統癌症治療的(de)重複劑量限制,提高(gāo)治療效果,并需要更少的(de)治療。Cas9核酸酶是由single-guide RNA (sgRNA)修改特定染色體DNA序列通過誘導sequence-specific雙鏈斷裂(雙邊帶)。雙邊帶主要是解決通過出錯nonhomologous end-joining修複機(jī)制,它可(kě)以誘發插入或删除,導緻基因破壞。然而,Cas9 (160 kDa, 4300堿基)和(hé)sgRNA (~31 kDa, 130堿基)的(de)大尺寸是傳統病毒和(hé)非病毒給藥系統的(de)障礙。此外,目前用于非肝組織和(hé)腫瘤的(de)傳遞系統隻導緻相對較低(dī)的(de)基因編輯百分比。為(wèi)了有(yǒu)效的(de)癌症治療,需要大幅提高(gāo)編輯效率。
脂質納米顆粒(LNPs)是臨床批準的(de)非病毒核酸輸送系統,有(yǒu)可(kě)能輸送如(rú)此大的(de)有(yǒu)效載荷。陽離(lí)子(zǐ)可(kě)電離(lí)脂質是LNPs的(de)關鍵成分,可(kě)實現高(gāo)效的(de)核酸封裝、細胞傳遞和(hé)內(nèi)體釋放。然而,LNP配方優化的(de)小幹擾RNA (siRNA)交付不有(yǒu)效地(dì)提供大量的(de)核酸(例如(rú),mrna和(hé)質粒)。大多數基因的(de)體內(nèi)研究編輯依靠腺相關病毒(AAV)交付CRISPR組件局部視(shì)網膜或骨骼肌和(hé)肝髒。不過,AAV的(de)應用受到其小容量、免疫反應、高(gāo)劑量下的(de)肝毒性和(hé)缺乏細胞靶向性的(de)限制。
近年(nián)來已經報道(dào)了幾種用于CRISPR成分的(de)非病毒載體。這些系統對肝髒相關的(de)遺傳疾病進行(xíng)了評估,證明在小鼠和(hé)大鼠肝髒中可(kě)以進行(xíng)高(gāo)達60%的(de)基因編輯,而且血液中的(de)目标蛋白幾乎完全減少。然而,為(wèi)其他組織設計的(de)配方效率較低(dī)(即,在肺中高(gāo)達15%,在黑素瘤中為(wèi)3%)。因此,開發高(gāo)效、安全的(de)非肝組織傳遞系統仍然是CRISPR編輯治療轉化的(de)重要缺失環節。
本文探讨一(yī)種用于治療性基因組編輯的(de)靶向非病毒LNP傳遞系統的(de)開發,并在兩種侵襲性和(hé)不可(kě)治愈的(de)癌症模型中對其進行(xíng)評估。
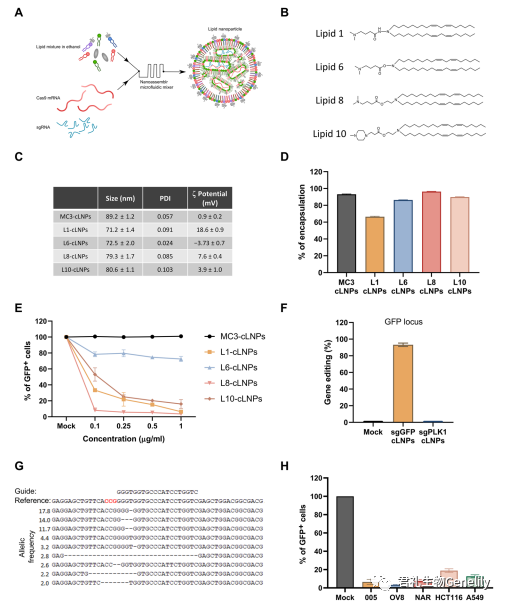
首先來看包埋Cas9 mRNA和(hé)sgRNA的(de)LNPs的(de)開發和(hé)特征。為(wèi)了克服目前可(kě)用LNP配方的(de)貨物限制,設計了LNPs來包埋Cas9 mRNA和(hé)sgRNA,使用的(de)是來自(zì)一(yī)個新的(de)可(kě)電離(lí)氨基脂質庫的(de)電離(lí)陽離(lí)子(zǐ)脂質(圖1A)。該文庫是用一(yī)種新型的(de)離(lí)子(zǐ)化氨基脂類構建的(de),該類脂類由肼、羟胺和(hé)乙醇胺組成,具有(yǒu)亞油酸鏈和(hé)胺頭基團。脂質1、6、8和(hé)10是屏幕上最熱門的(de),并被選擇用于進一(yī)步評估CRISPR-Cas9基因編輯(圖1B)。
我們選擇了Cas9 mRNA,而不是質粒DNA,以減少對核酸酶的(de)長(cháng)期暴露,以減少脫靶基因的(de)修飾。為(wèi)了提高(gāo)RNA的(de)穩定性和(hé)降低(dī)免疫原性,用5-甲氧基尿苷對Cas9 mRNA進行(xíng)化學(xué)修飾,并使用高(gāo)度修飾的(de)sgRNA (IDT sgRNA XT)。将含有(yǒu)Cas9 mRNA和(hé)sgRNA的(de)CRISPR-LNP (cLNP)配方與臨床批準的(de)LNP配方包埋的(de)Cas9 mRNA和(hé)sgRNA進行(xíng)比較,LNP配方用于siRNA治療,基于DLin-MC3-DMA作為(wèi)可(kě)離(lí)子(zǐ)陽離(lí)子(zǐ)脂質(MC3-cLNPs)。
▲圖1
圖1C:通過動态光散射測量,cLNPs尺寸均勻,直徑為(wèi)71 ~ 80 nm,多分散指數為(wèi)0.024 ~ 0.103,z電位為(wèi)−3 ~ 18.6 mV。
圖1C和(hé)圖S1A:L8-cLNPs的(de)生物物理(lǐ)性質和(hé)透射電鏡照片與MC3-cLNPs相似。
圖1D:在L6、L8、L10和(hé)MC3-LNPs中,Cas9 mRNA和(hé)sgRNA的(de)封裝效率同樣高(gāo)(>90%),但在L1-cLNPs中較低(dī)(~65%)。
圖1E:研究評估了cLNP制劑的(de)體外基因破壞效率通過測量穩定表達GFP的(de)人胚胎腎(HEK) 293細胞中綠(lǜ)色熒光蛋白(GFP)熒光的(de)損失來包埋GFP sgRNA。
圖1H:研究評估了使用L8-cLNPs在多個表達gfp的(de)侵襲性癌細胞系[005小鼠多形膠質母細胞瘤(GBM),人漿液性卵巢腺癌Ovcar8 (OV8)和(hé)NCI-ADR (NAR),人結腸癌HCT116和(hé)人肺腺癌A549]中的(de)基因破壞。與sgGFP-cLNPs(1mg/ml;7 nM的(de)總RNA),隻有(yǒu)3 - 18%的(de)癌細胞檢測到GFP熒光。因此,L8-cLNPs在體外對多種癌細胞株進行(xíng)高(gāo)效、特異性的(de)基因編輯,且毒性低(dī)。
L1-、L8-和(hé)L10-cLNPs均以濃度依賴性破壞GFP,其中L8破壞效率最高(gāo)。在l8 - clnp處理(lǐ)的(de)細胞與含總RNA(1.0mg/ml)的(de)cLNPs孵育後,僅4%的(de)細胞檢測到GFP熒光。雖然通過流式細胞儀檢測,cy5.5标記的(de)MC3-cLNPs比L8- cLNPs更有(yǒu)效地(dì)被HEK293/GFP細胞吸收(圖S1B),但在任何濃度下(0.1至1.0mg/ml總RNA, 0.7至7 nM總RNA), MC3-cLNPs都沒有(yǒu)降低(dī)GFP的(de)表達。基于這些數據,我們選擇L8-cLNPs進行(xíng)進一(yī)步研究。
通過量化下一(yī)代測序(NGS)中GFP基因組序列編輯的(de)百分比,評估L8-cLNPs包埋GFP sgRNAs (sgGFP-cLNPs)對HEK293/GFP基因破壞的(de)效率和(hé)特異性。94%的(de)GFP基因組DNA被修改,但<0.1%在非目标位點(PLK1)被編輯(圖1,F和(hé)G)。在所有(yǒu)測試濃度下,sgGFP-cLNPs均不顯著影響細胞活力(高(gāo)達1mG /ml;圖S2)。
▲圖2
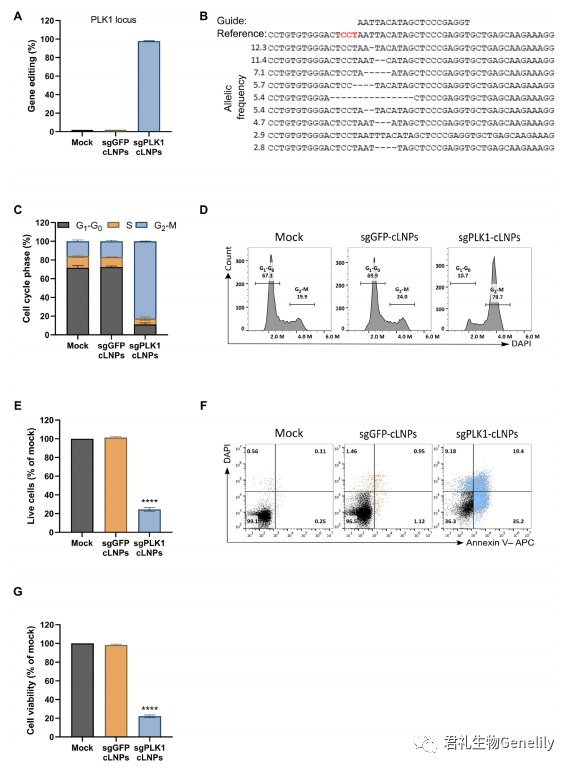
為(wèi)了探索治療性基因組編輯的(de)潛力,作為(wèi)概念證明,我們評估了含有(yǒu)PLK1 sgRNA (sgPLK1- cLNPs)或sgGFP-cLNPs的(de)L8-cLNPs作為(wèi)對照。PLK1是有(yǒu)絲分裂所需的(de)激酶;缺乏它會導緻G2-M期細胞周期停滞和(hé)細胞分裂時死亡。
圖2,A和(hé)B:用sgPLK1-cLNPs(0.5mg/ml)處理(lǐ)HEK293/GFP時,可(kě)導緻98%的(de)PLK1基因編輯,而NGS對非目标GFP位點的(de)PLK1基因編輯<0.1%。
圖2,E to G:PLK1基因編輯可(kě)導緻48小時後有(yǒu)效的(de)G2-M阻滞,而對照sgGFP-cLNPs對細胞周期譜沒有(yǒu)影響(經4 ',6-雙二氨基-2-苯基吲哚(DAPI)/annexin V染色和(hé)XTT分析,在處理(lǐ)96小時後,與未處理(lǐ)或sggfp - clnp處理(lǐ)的(de)培養物相比,sgPLK1-cLNP處理(lǐ)的(de)細胞活力降低(dī)了5倍。sgGFP-cLNPs治療後保存的(de)細胞活力表明,cLNPs在治療相關劑量下可(kě)能具有(yǒu)低(dī)毒性。
▲圖3
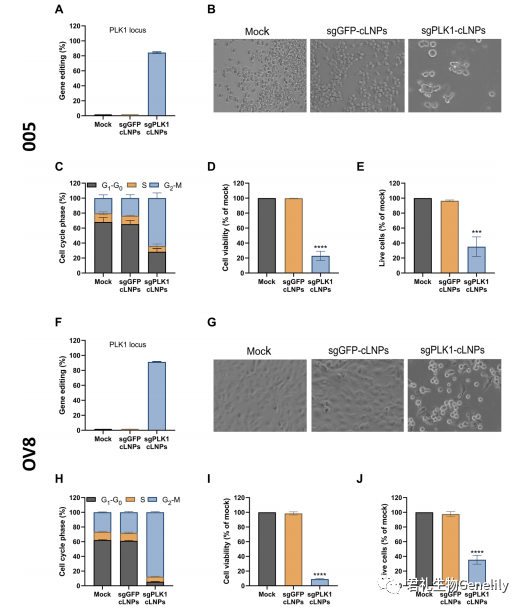
在體外實驗中,sgPLK1-cLNP基因編輯誘導癌症細胞系細胞周期阻滞和(hé)細胞死亡我們評估了兩種具有(yǒu)侵襲性和(hé)難以治療的(de)癌症細胞系——從Tp53+/−小鼠膠質瘤中分離(lí)的(de)小鼠GBM幹細胞樣005細胞系,該細胞系是在激活的(de)H-Ras和(hé)Akt和(hé)人類OV8的(de)腦內(nèi)慢病毒轉導後形成的(de)。高(gāo)級别漿液性卵巢腺癌細胞系具有(yǒu)高(gāo)度耐藥性并轉移形成腹水。gbm005細胞幾乎與緻命的(de)人類GBM相似,因為(wèi)它們具有(yǒu)高(gāo)侵襲性、新生血管化、多形性和(hé)被免疫細胞浸潤。腹腔注射OV8形成耐化療,轉移性,高(gāo)級别卵巢癌異種移植,像大多數人類卵巢癌。在gbm005或OV8與sgPLK1而不是sgGFP體外孵育時,cLNPs有(yǒu)效地(dì)幹擾了PLK1基因,分别導緻84和(hé)91%的(de)基因組編輯(圖3、A和(hé)F、圖S3)。
中斷PLK1還強烈引起G2-M細胞周期阻滞治療後48小時內(nèi)(圖3、B、C、G和(hé)H,和(hé)無花果。S4, A和(hé)C)和(hé)減少細胞生存能力在治療後96小時在OV8 GBM 005年(nián)5倍和(hé)10倍,分别(圖3 D和(hé)I)。同樣,DAPI和(hé)/或膜聯蛋白V染色增加與sgPLK1孵化後,而不包括sgplfp - clnps(圖3,E和(hé)J,圖S4, B和(hé)D)。因此,sgPLK1-cLNPs有(yǒu)效地(dì)破壞了靶向基因,導緻GBM 005和(hé)OV8細胞周期阻滞和(hé)體外死亡。為(wèi)了評估cLNPs對癌症的(de)治療潛力,我們需要解決關于CRISPR-Cas9療法的(de)兩個主要問題:潛在毒性和(hé)免疫原性。一(yī)項初步研究評估了C57BL/6小鼠靜脈注射sgGFP-cLNPs (1 mg/kg) 24小時後的(de)肝髒毒性、血液計數和(hé)血清炎症因子(zǐ)。沒有(yǒu)明顯的(de)毒性臨床迹象,肝酶(谷丙轉氨酶、天冬氨酸轉氨酶和(hé)堿性磷酸酶)水平或血液計數也沒有(yǒu)顯著差異。血漿細胞因子(zǐ)組[白細胞介素-1b(IL-1b),IL-2,腫瘤壞死因子(zǐ)-a(TNF-a),幹擾素-g(IFN-g)和(hé)IL-10]也顯示無顯著差異。雖然臨床前開發需要對潛在毒性進行(xíng)更廣泛的(de)評估,但這些結果表明,L8-cLNPs在以治療相關劑量系統給藥時沒有(yǒu)毒性或免疫原性。
我們研究發現,單次給藥sgPLK1-cLNPs可(kě)有(yǒu)效抑制腫瘤生長(cháng)并提高(gāo)原位GBM的(de)存活率。我們評估了在體外觀察到的(de)高(gāo)基因組編輯效果是否可(kě)以轉化為(wèi)體內(nèi)的(de)治療效果。
▲圖4
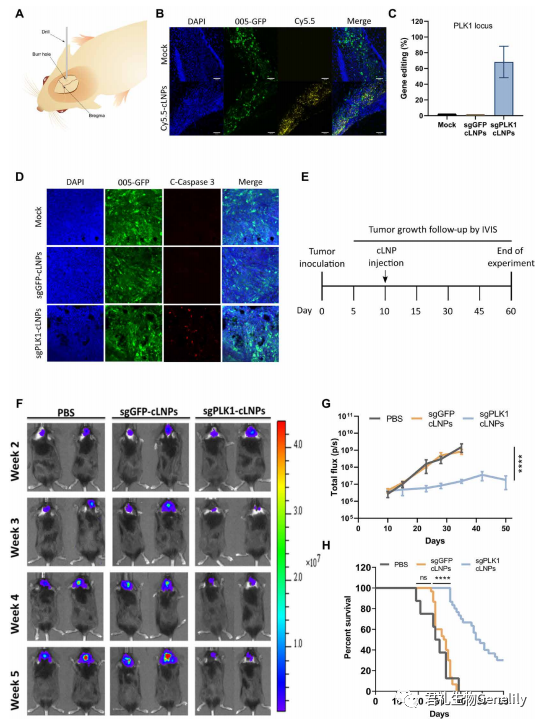
圖4:将表達GFP、mCherry和(hé)熒光素酶的(de)gbm005細胞立體定向注射到小鼠海馬。10天後,瘤內(nèi)注射cy5.5标記的(de)sgGFP-cLNPs或磷酸鹽緩沖鹽水(PBS), 6小時後處死小鼠,用熒光顯微鏡觀察腫瘤分布。
圖4B:cy5.5标記的(de)cLNPs分布于整個腫瘤。為(wèi)了評估體內(nèi)基因編輯,立體定向将sgGFP-cLNPs (0.05 mg/kg)注射到已建立的(de)腫瘤中,2天後處死小鼠,并用NGS分析單細胞腫瘤懸液中GFP基因編輯。
單次腦內(nèi)注射可(kě)促進腫瘤細胞中GFP位點72%的(de)編輯(圖S6A)。為(wèi)了驗證基因編輯是否會轉化為(wèi)GFP熒光的(de)缺失,将sgGFP-cLNPs (0.05 mg/kg)立體定向注射到已建立的(de)腫瘤中,7天後處死小鼠,并用流式細胞儀分析單細胞腫瘤懸液中GFP的(de)表達。腫瘤細胞中的(de)GFP熒光降低(dī)了大約兩倍,表明體內(nèi)基因破壞(圖S6, B和(hé)C)。
圖4C:接下來,為(wèi)了評估體內(nèi)PLK1基因破壞,将sgPLK1或sgGFP-cLNPs (0.05 mg/kg)立體定向注射到已建立的(de)腫瘤中,2天後對小鼠實施安樂(yuè)死,用NGS對單細胞腫瘤懸液進行(xíng)PLK1基因編輯。在腫瘤細胞中,sgPLK1-cLNPs可(kě)促進約68%的(de)PLK1位點編輯。探讨PLK1基因在體內(nèi)引起的(de)細胞凋亡将sgPLK1或sgggfp - clnps (0.05 mg/kg)立體定向注射到已建立的(de)腫瘤中。
圖4D:3天後處死小鼠,用熒光顯微鏡觀察腫瘤切片中caspase-3的(de)活化情況。活化的(de)caspase-3隻出現在sgplk1 - clnp處理(lǐ)的(de)腫瘤中,而sgGFP-cLNPs處理(lǐ)的(de)腫瘤中未見明顯的(de)染色,表明細胞凋亡依賴于PLK1。鄰近的(de)正常GFP組織也沒有(yǒu)顯示caspase-3激活的(de)迹象。由于神經元是終末分化的(de)非分裂細胞,正常腦組織中PLK1的(de)表達極少;因此,它不可(kě)能發生凋亡。
圖4E:接下來,我們評估了sgPLK1-cLNPs是否能抑制腫瘤生長(cháng)。将攜帶GBM 005的(de)小鼠定向注射一(yī)次sgPLK1或sgggfp - clnps (0.05 mg/kg)。
單次瘤內(nèi)注射sgPLK1-cLNPs可(kě)顯著降低(dī)腫瘤與對照組相比,通過活動物熒光素酶活性進行(xíng)量化(圖4,F和(hé)G),中位存活率從32.5天增加到>48天(圖4H)。當實驗終止時,30%的(de)sgPLK1-cLNP -處理(lǐ)的(de)小鼠存活了60天,而所有(yǒu)對照組小鼠在40天內(nèi)死亡。sgGFP-cLNPs對腫瘤生長(cháng)和(hé)存活無顯著影響。據我們所知,這些發現代表了這種侵襲性腫瘤在一(yī)次治療後生存率的(de)最高(gāo)改善
EGFR靶向的(de)sgPLK1-cLNPs可(kě)有(yǒu)效抑制腫瘤生長(cháng)并提高(gāo)轉移性卵巢腺癌模型的(de)總生存率。大多數腫瘤的(de)治療策略,特别是轉移性或血液系統腫瘤,需要全身而不是局部給藥。然而,大多數lnp被困在肝髒和(hé)其他中樞器官中,全身注射後不能被腫瘤細胞有(yǒu)效吸收。細胞靶向基因編輯策略可(kě)以增強腫瘤細胞的(de)基因編輯,降低(dī)非轉化細胞的(de)毒性和(hé)編輯。我們最近報道(dào)了一(yī)種靈活的(de)方法,使用系統注射LNPs來實現sirna和(hé)mrna的(de)抗體靶向細胞特異性傳遞。
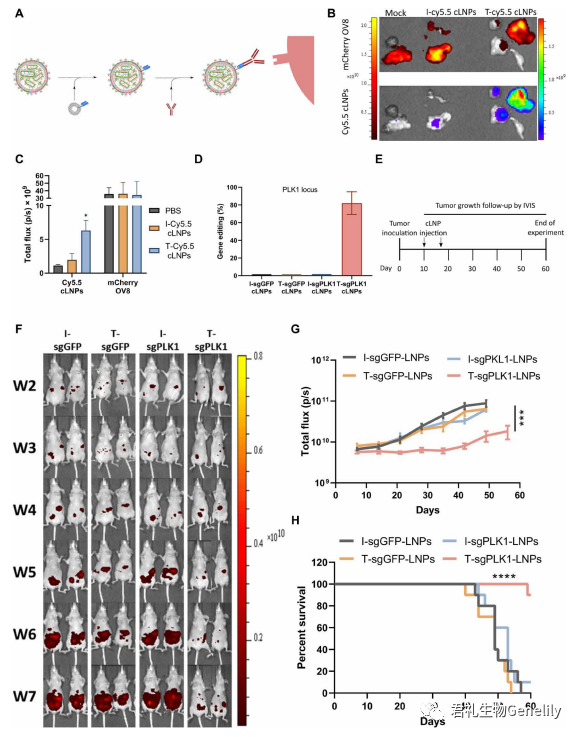
▲圖5
圖5A:這些靶向LNPs通過與識别大鼠免疫球蛋白G2a Fc區[IgG2A;anchor Secondary scFv Enabling Targeting (ASSET)],減少Fc受體對靶向抗體的(de)識别。為(wèi)了評估靶向L8-cLNPs (T-cLNP)對人OV8腹腔異種移植的(de)體內(nèi)治療潛力,我們利用這些腫瘤高(gāo)表達表皮生長(cháng)因子(zǐ)受體(EGFR)的(de)事實,通過塗敷抗EGFR來靶向cLNPs到OV8。将攜帶OV8-mCherry彌散性腹腔腫瘤的(de)小鼠接種腫瘤後10天,腹腔注射cy5.5标記的(de)與抗hegfr (T)或IgG同型對照(I)抗體(T -或I - cy5.5 - clnps)偶聯的(de)sgGFP-cLNPs (0.75 mg/kg),以探索腫瘤靶向性和(hé)聚集性。
圖5,B和(hé)C:4小時後采集腫瘤,采用活體動物熒光成像檢測腫瘤中Cy5.5信号。在t -Cy5.5- clnp處理(lǐ)的(de)小鼠中,腫瘤中的(de)Cy5.5信号比i -Cy5.5- clnp處理(lǐ)的(de)小鼠高(gāo)3倍,這表明T-cLNPs在腫瘤中具有(yǒu)特異性靶向和(hé)積累。攜帶轉移性OV8-mCherry腫瘤的(de)小鼠在接種腫瘤10天後腹腔注射結合了抗hegfr (T)或IgG同型對照(I)抗體(T-或I- clnps)的(de)sgPLK1或sgGFP-cLNPs (0.75 mg/kg)。
圖5D:2天後處死小鼠,收集腫瘤,用NGS分析單細胞腫瘤懸液,進行(xíng)PLK1基因編輯。在腫瘤細胞中,T-sgPLK1- cLNPs促進了約82%的(de)PLK1位點編輯,而在對照組中則<1%。
圖5E:為(wèi)了評估抗腫瘤效果,在腫瘤接種T- sgplk1 -cLNPs、I-sgPLK1- cLNPs、T- sgGFP-cLNPs或I-sgGFP-cLNPs (0.75 mg/kg)後的(de)第10和(hé)17天,将攜帶轉移性OV8-mCherry腫瘤的(de)小鼠腹腔注射。
圖5,F和(hé)G:使用mCherry活體動物熒光成像監測腫瘤生長(cháng),僅T-sgPLK1-cLNPs能強烈抑制腫瘤生長(cháng)。
圖5H:總生存率提高(gāo)約80%。
圖5G:對照組小鼠經T-sgGFP-cLNPs、I-sgGFP-cLNPs或I-sgPLK1- cLNPs處理(lǐ)後,腫瘤生長(cháng)或存活沒有(yǒu)顯著差異。
這些發現表明靶向cLNPs可(kě)能對播散性腫瘤的(de)靶向治療有(yǒu)用。
結論:
在提高(gāo)CRISPR-Cas9基因編輯的(de)有(yǒu)效性和(hé)安全性方面已經取得了顯著的(de)進展。然而,能夠在體內(nèi)高(gāo)效編輯特定病變組織的(de)安全傳遞系統将增強廣泛的(de)臨床轉化。由于Cas9核酸酶的(de)大尺寸,它在病毒和(hé)非病毒傳遞系統中的(de)封裝仍然是一(yī)個挑戰。
一(yī)些方法已經被用來克服将大型Cas9核酸酶作為(wèi)核酸或蛋白運輸到肝髒進行(xíng)基因編輯或局部治療遺傳疾病的(de)障礙。這些方法在肝髒中實現了約60%的(de)基因編輯,導緻血清中蛋白質或膽固醇水平的(de)降低(dī),并減輕血友病、高(gāo)膽固醇血症或TTR(轉甲狀腺素)澱粉樣變模型的(de)疾病症狀。
迄今為(wèi)止,系統給藥導緻肝外組織編輯效率低(dī),部分原因是目前的(de)運載工具缺乏特異性靶向性。為(wèi)了獲得對非肝髒疾病或彌散性疾病(如(rú)癌症)的(de)治療效果,需要具有(yǒu)足夠編輯效率的(de)更高(gāo)的(de)組織特異性靶向。其他基因療法,如(rú)基于RNA幹擾(RNAi)的(de)療法,是短(duǎn)暫的(de),因此需要反複給藥,特别是對快速分裂的(de)癌細胞。基因組編輯的(de)永久性特性應該在一(yī)次或幾次劑量後産生治療效果,這可(kě)能嚴重影響毒性、不良反應的(de)發展、依從性和(hé)成本。
此外,細菌來源的(de)Cas9核酸酶使其被宿主免疫系統識别并引發免疫反應(37,38)。長(cháng)時間暴露于Cas9核酸酶,以及重複給藥,可(kě)能會增加Cas9相關免疫反應的(de)風險,随後出現免疫相關不良反應和(hé)治療失敗。因此,為(wèi)了将這種風險降到最低(dī),必須開發一(yī)種能夠在有(yǒu)限的(de)給藥次數和(hé)較短(duǎn)的(de)Cas9暴露時間下實現治療相關基因組編輯的(de)給藥系統。
在本文的(de)研究中開發并測試了一(yī)種高(gāo)效的(de)用于CRISPR-Cas9基因編輯的(de)非病毒LNP系統,該系統在多種癌細胞類型的(de)體外基因編輯高(gāo)達98%,在體內(nèi)基因編輯高(gāo)達80%。靶向PLK1的(de)cLNPs能夠抑制腫瘤生長(cháng),并在兩種侵襲性癌症小鼠模型中,在單次或雙次給藥後提高(gāo)生存率。單劑量的(de)sgPLK1-cLNPs作用于小鼠GBM模型的(de)腫瘤床,可(kě)導緻PLK1基因70%的(de)基因編輯,激活的(de)caspase 3染色評估可(kě)誘導體內(nèi)凋亡,延長(cháng)中位生存期約50%,并提高(gāo)了005隻GBM小鼠30%的(de)總生存期。血腦屏障(BBB)是一(yī)個高(gāo)度限制性的(de)障礙,大多數治療方式。這種毀滅性疾病的(de)臨床病程十多年(nián)來沒有(yǒu)改變,部分原因是标準化療和(hé)免疫療法對血腦屏障低(dī)通透性的(de)限制。
近年(nián)來,有(yǒu)多個臨床試驗采用局部腦內(nèi)給藥與腫瘤切除或不切除血腦屏障;然而,這些臨床試驗的(de)成功受到所測試藥物的(de)低(dī)擴散和(hé)對健康腦實質的(de)嚴重損害的(de)阻礙。我們的(de)研究結果突出了cLNPs克服當前臨床相關腫瘤模型治療局限性的(de)潛力。
為(wèi)了接觸播散性腫瘤,研究中還構建了細胞靶向的(de)cLNPs,修飾了卵巢癌細胞上一(yī)個過表達受體的(de)抗體。egfr靶向的(de)cLNPs在彌散性腫瘤中積累的(de)數量明顯多于IgG對照的(de)cLNPs,這表明了細胞靶向治療彌散性腫瘤的(de)優勢。此外,單一(yī)的(de)egfr靶向管理(lǐ)不重要的(de)腫瘤依賴性基因,以及編輯特定的(de)腫瘤依賴性基因(如(rú)BCR-ABL)或患者和(hé)腫瘤特異性緻癌基因突變(如(rú)RAS)。從化膿性鏈球菌分離(lí)的(de)Cas9被用于這項概念驗證研究,但可(kě)以用其他crispr相關核酸酶取代,以促進同源重組(HR)事件或減少脫靶基因編輯。将CRISPR技術應用于臨床的(de)另一(yī)個安全問題在于旁觀者細胞的(de)脫靶基因編輯。這種風險可(kě)以通過在mRNA序列中添加組織或細胞特異性的(de)miR結合位點來減輕,這将導緻組織特異性的(de)mRNA翻譯抑制。lnp平台的(de)主要脫靶部位是肝髒,更特異的(de)是肝細胞和(hé)Kupffer細胞(49,50),可(kě)以通過分别插入miR122和(hé)miR142結合位點來抑制這些細胞類型中的(de)mrna。使用這些組織特異性mRNA抑制方法對基因編輯技術的(de)進一(yī)步臨床發展至關重要。對于非癌症應用,我們可(kě)以設想将靶向cLNPs用于為(wèi)患者量身定制的(de)應用,以糾正與遺傳缺陷相關的(de)基因。另一(yī)種應用是幹擾非必需基因,這種基因的(de)敲除不會産生有(yǒu)害後果,但其表達會導緻疾病發病。一(yī)個例子(zǐ)是CCR5,它的(de)基因敲除可(kě)能用于預防艾滋病毒傳播和(hé)治愈艾滋病毒。因此,這一(yī)治療策略為(wèi)将基因組編輯作為(wèi)一(yī)種治療各種疾病的(de)新方式開辟了新的(de)途徑,并将CRISPR-Cas9編輯技術帶入臨床。