
簡介
mRNA療法是一(yī)種新型的(de)基因療法,合成mRNA為(wèi)任何給定蛋白質、蛋白質片段或肽的(de)合成提供模闆,并有(yǒu)助于廣泛的(de)藥物應用,包括癌症免疫治療的(de)不同模式。
刺激模式識别受體從而産生抗病毒型先天免疫反應的(de)能力使基于mRNA的(de)疫苗具備了固有(yǒu)的(de)佐劑性。核苷修飾和(hé)消除雙鏈RNA可(kě)以降低(dī)mRNA的(de)免疫調節活性,增加和(hé)延長(cháng)蛋白質的(de)産生。與提高(gāo)轉染效率和(hé)促進淋巴系統靶向性的(de)基于納米顆粒的(de)制劑相結合,核苷修飾的(de)mRNA能夠有(yǒu)效遞送細胞因子(zǐ)、共刺激受體或治療性抗體。與相應的(de)重組蛋白相比,生物活性分子(zǐ)可(kě)以改善藥代動力學(xué)、藥效學(xué)和(hé)安全性。
本文強調了基于mRNA的(de)癌症治療領域的(de)進展,為(wèi)關鍵的(de)臨床前發展和(hé)不斷發展的(de)臨床前景提供了見解。
結果與讨論
在過去(qù)的(de)30年(nián)裏,人們做(zuò)出了大量努力來提高(gāo)細胞內(nèi)的(de)穩定性、翻譯效率和(hé)mRNA的(de)攝取。這些優化是通過修改其非編碼元素(5′cap結構及其封蓋效率、5′-和(hé)3′-未翻譯)實現的(de)區域(UTR),3′聚(A)尾)和(hé)編碼區,并通過轉染和(hé)配方技術的(de)發展(圖1)。
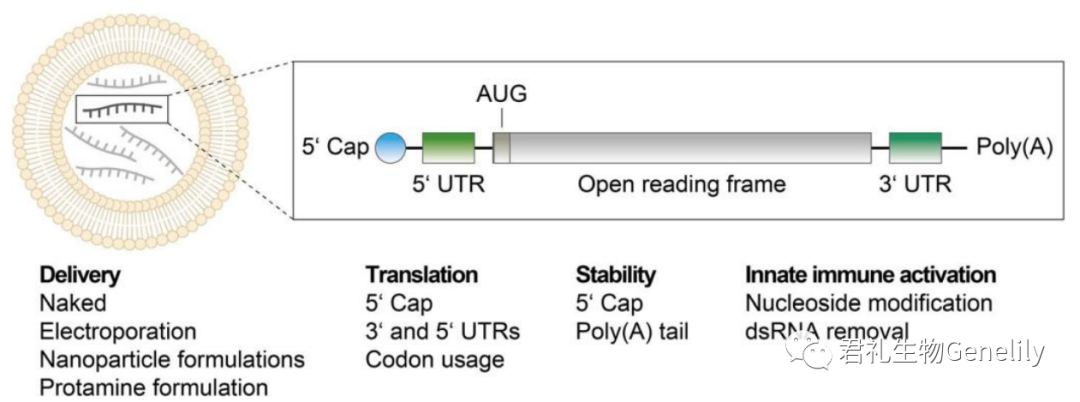
圖1:mRNA療法的(de)遞送和(hé)結構元件。脂質基mRNA納米粒(左)和(hé)合成mRNA(右)的(de)結構,包括5′cap、5′和(hé)3′UTR、啓動開放閱讀框(AUG)的(de)起始密碼子(zǐ)和(hé)聚(a)尾。列出了不同的(de)mRNA遞送方法,以及影響mRNA翻譯、穩定性和(hé)先天性免疫激活潛力的(de)可(kě)調結構元件。UTR:非翻譯區;ds:雙絞線
在這些進展的(de)基礎上,合成mRNA已成為(wèi)一(yī)種多功能的(de)遺傳信息傳遞系統,用于誘導細胞産生肽和(hé)蛋白質。
合成的(de)mRNA為(wèi)單鏈(ss),包含一(yī)個5′端帽、包含編碼區的(de)UTR和(hé)一(yī)個3′多聚體(a)尾巴。mRNA不會進入細胞核,也不會整合到基因組中,翻譯發生在細胞質中,來自(zì)合成mRNA的(de)蛋白質與來自(zì)內(nèi)源性mRNA的(de)蛋白質無法區分。蛋白質經過翻譯後修飾,并通過靶向序列或跨膜結構域進入亞細胞區,如(rú)分泌途徑、細胞膜、細胞核、線粒體或過氧化物酶體。最終,蛋白質被降解,pep-肽出現在主要的(de)組織相容性(MHC)複合物上。
在癌症免疫治療中,mRNA最先進的(de)應用是治療性疫苗接種,它提高(gāo)了mRNA傳遞遺傳信息的(de)能力及其固有(yǒu)的(de)免疫刺激活性。然而,IFN刺激的(de)基因(ISG),如(rú)IFN誘導的(de)雙鏈(ds)RNA激活的(de)蛋白激酶(PKR)和(hé)2′,5′-寡腺苷酸合成酶(OAS)以及随後的(de)RNA酶L表達,啓動了抗病毒防禦狀态,其特征是mRNA翻譯停滞和(hé)mRNA降解靶向性增加。
mRNA在癌症免疫治療中的(de)其他應用包括T細胞和(hé)自(zì)然殺傷(NK)細胞與抗原受體的(de)工程及其應用作為(wèi)多種免疫和(hé)非免疫細胞中免疫活性蛋白質的(de)模闆(圖2)。
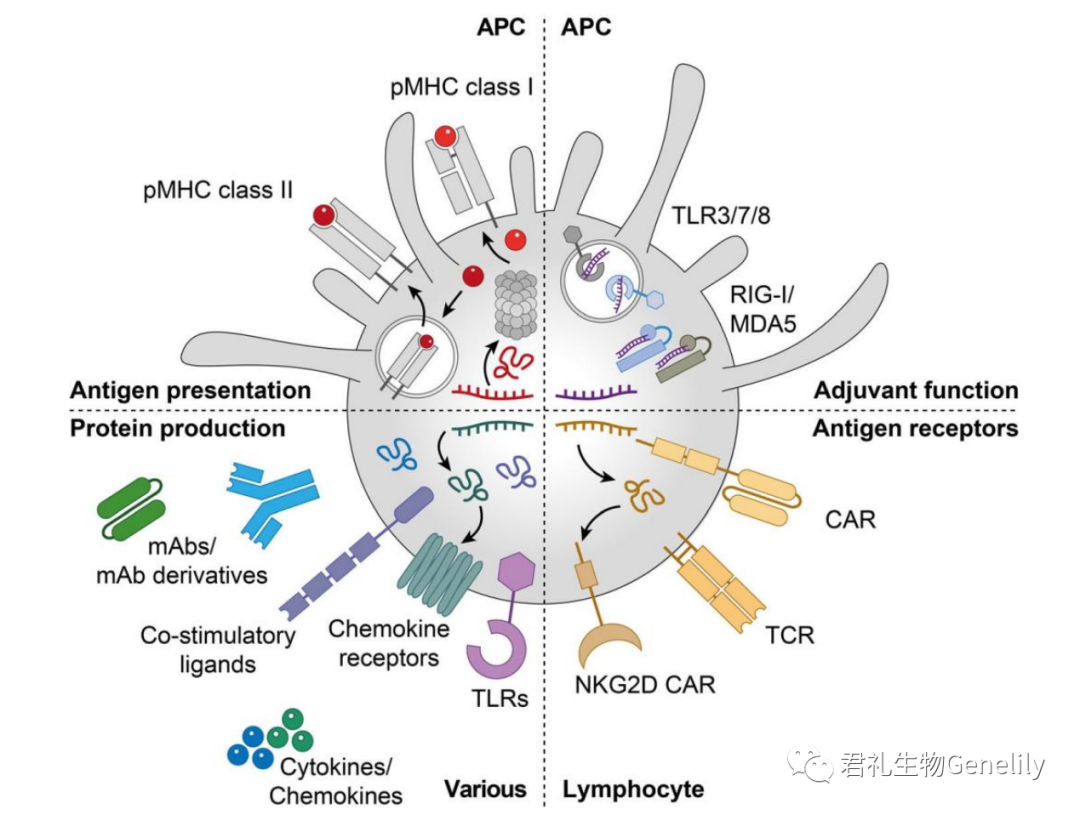
圖2:腫瘤免疫治療中的(de)mRNA療法。mRNA用于抗癌疫苗接種,它将癌症抗原輸送至APC,在MHC I類和(hé)II類(左上)上呈現,并通過結合APC表達的(de)PRR(右上)刺激先天性免疫激活,将抗原受體(如(rú)CARs和(hé)TCR)引入淋巴細胞(右下),并允許表達包括TLR在內(nèi)的(de)免疫調節蛋白,不同細胞亞群中的(de)趨化因子(zǐ)受體、共刺激配體、細胞因子(zǐ)、趨化因子(zǐ)和(hé)不同形式的(de)單克隆抗體(左下)。抗原提呈細胞;CAR:嵌合抗原受體;單克隆抗體:單克隆抗體;MDA5:黑色素瘤分化相關蛋白5;pMHC:肽主要組織相容性複合物;NKG2D:自(zì)然殺手組2D;模式識别受體;RIG-I:維甲酸誘導基因1;TCR:T細胞受體;TLR:Toll樣受體
癌症疫苗接種包括誘導腫瘤特異性T細胞反應,通過在免疫刺激的(de)情況下提供腫瘤抗原,潛在地(dì)能夠進行(xíng)腫瘤再注射。mRNA疫苗編碼TSA或TAA的(de)全部或部分序列,不依賴于事先确定患者的(de)人類白細胞抗原(HLA)單倍型或表位預測。
表1提供了使用mRNA疫苗進行(xíng)的(de)所有(yǒu)現行(xíng)、已完成或終止的(de)II期和(hé)III期臨床試驗的(de)總結。
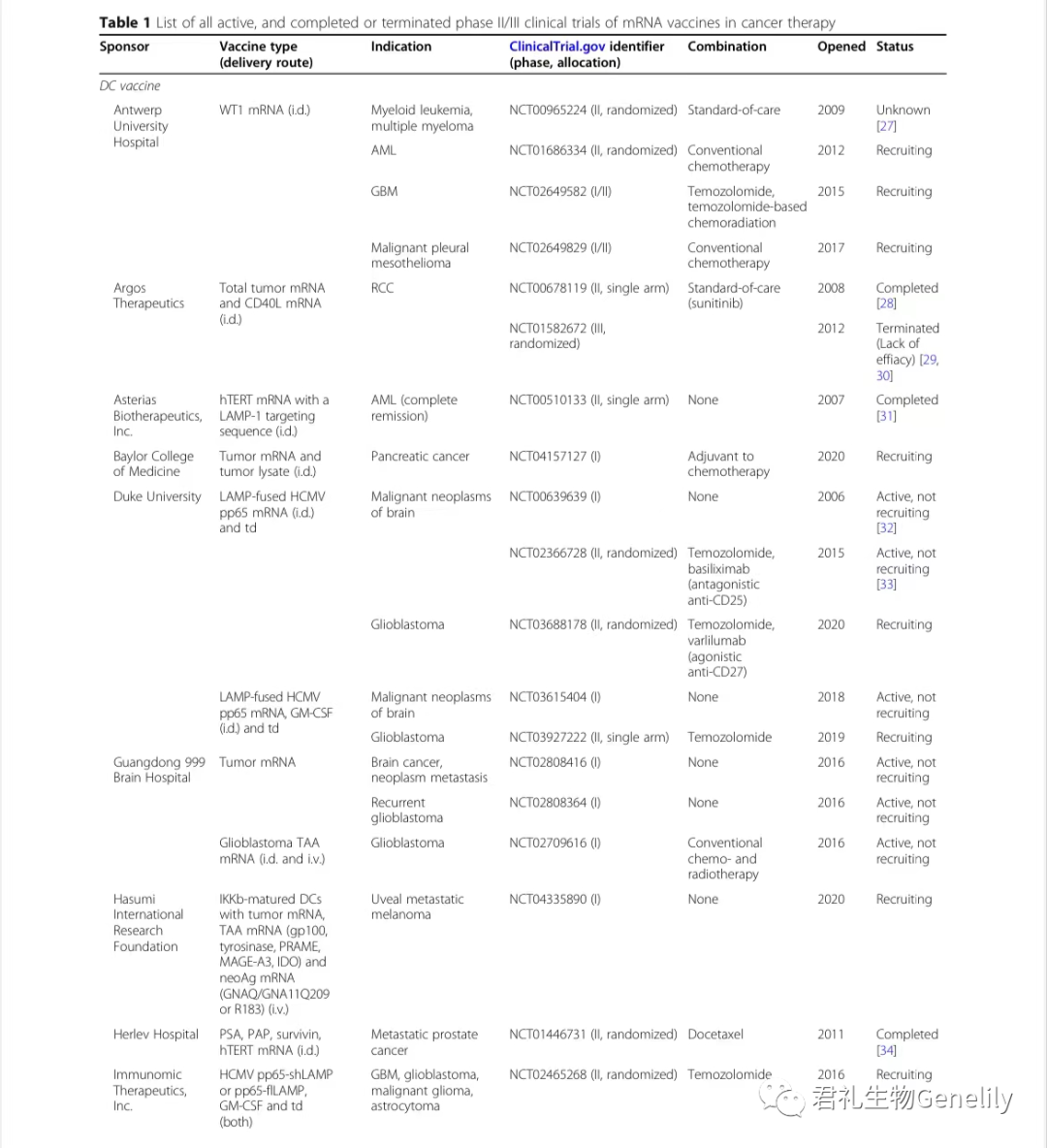
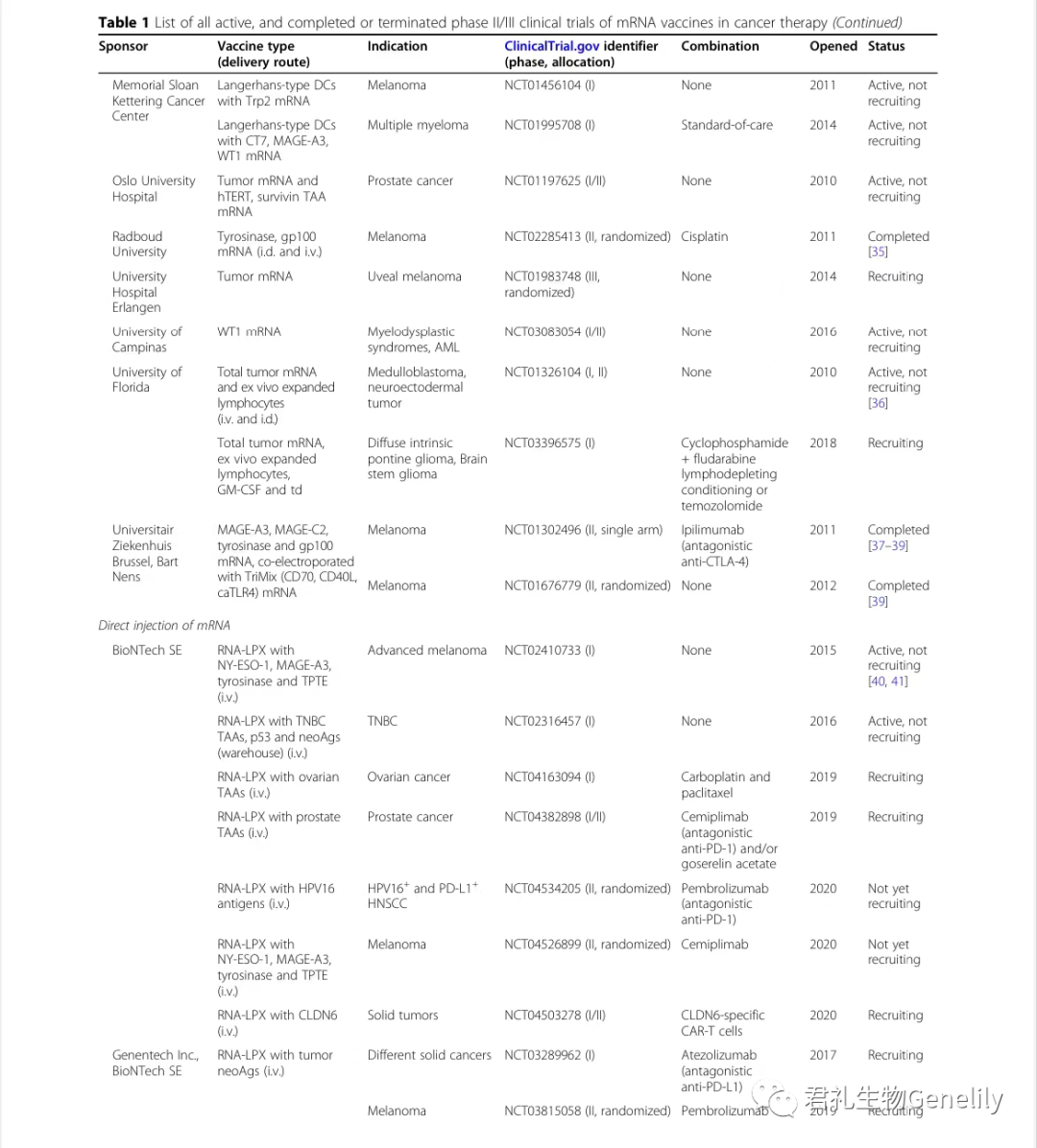
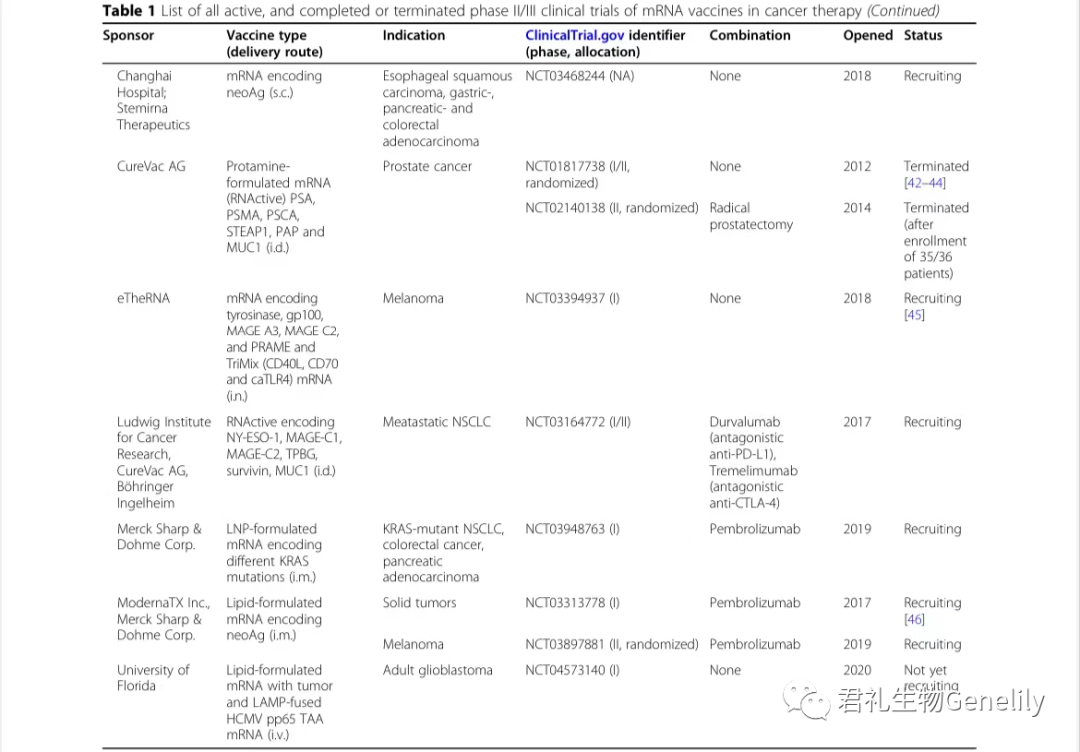
表1:來自(zì)臨床試驗。gov(關鍵詞:癌症、mRNA、疫苗)于2020年(nián)11月1日發布,PubMed文獻檢索。
用mRNA編碼腫瘤抗原的(de)脈沖DC的(de)方法之一(yī)是使用從自(zì)體腫瘤中提取的(de)大量mRNA。由mRNA負載的(de)DC疫苗誘導的(de)T細胞反應相當弱,這可(kě)能是導緻臨床療效低(dī)下的(de)原因。DC分化、成熟和(hé)抗原負載直接影響DC歸巢和(hé)T細胞共刺激,是進一(yī)步改進該方法的(de)目标。
同源T細胞幫助是決定疫苗誘導T細胞應答程度的(de)關鍵因素。這要求疫苗抗原呈現在DC的(de)MHC II類分子(zǐ)上。轉染DC的(de)mRNA進行(xíng)細胞質翻譯,進入內(nèi)源性處理(lǐ)室,因此呈現在MHC I類分子(zǐ)上,而不是MHC II類分子(zǐ)上。通過将抗原穿過溶酶體區,如(rú)将疫苗抗原融合到溶酶體相關膜蛋白(LAMP),或融合到MHC I類細胞胞漿和(hé)跨膜結構域,已經遵循了幾種策略來增強MHC II類抗原呈遞。當ssRNA和(hé)dsRNA觸發TLR激活時,帶有(yǒu)mRNA的(de)DC脈沖提供了一(yī)個成熟信号。
癌症的(de)另一(yī)種免疫治療方法是通過穩定的(de)免疫系統将T細胞重新定向到腫瘤細胞上整合腫瘤特異性抗原受體,或與T細胞受體(TCR)結合,TCR識别來自(zì)細胞內(nèi)和(hé)細胞外抗原的(de)MHC呈現的(de)表位,或與腫瘤表面抗原結合且不依賴MHC的(de)CAR結合,然後在細胞培養系統中擴增T細胞。
mRNA電穿孔導緻CAR在T細胞表面表達約7天,而在靶細胞計數器上內(nèi)化的(de)CAR不會恢複。CAR結構的(de)分子(zǐ)結構(例如(rú),共刺激do-mains)可(kě)能會影響表達水平和(hé)持續時間。盡管CAR表達的(de)水平和(hé)持續性與殺傷效力呈正相關,但體外研究表明,高(gāo)CAR表達有(yǒu)利于激活誘導的(de)細胞死亡(AICD),高(gāo)量的(de)mRNA輸入可(kě)影響生存能力。
早期研究表明,mRNA轉染的(de)T細胞能有(yǒu)效地(dì)裂解抗原表達的(de)腫瘤細胞,TCR對NY-ESO-1、MART-1或p53具有(yǒu)特異性,CAR針對CD19。體內(nèi)抗腫瘤效應的(de)第一(yī)個證據來自(zì)在卵巢癌異種移植模型中轉染了編碼HER-2/neu特異性CAR mRNA的(de)PBL。臨床I期研究探索了針對各種抗原的(de)mRNA CAR-T細胞(表2)。
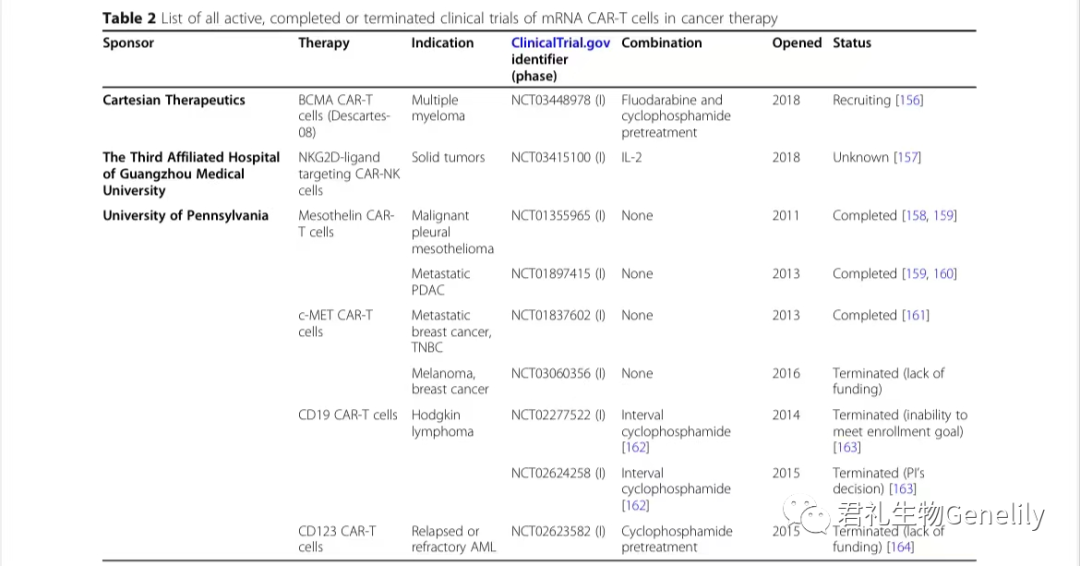
表2:來自(zì)臨床試驗。gov(關鍵詞:癌症、mRNA、CAR)于2020年(nián)11月1日發布,PubMed文獻研究。
mRNA還被用于傳遞完整的(de)IgG單克隆抗體或支架,包括工程化的(de)雙特異性抗體片段,并解決藥代動力學(xué)(如(rú)短(duǎn)半衰期、快速清除)以及制造挑戰(如(rú)聚集體),以加速臨床開發。
單克隆抗體是一(yī)種公認的(de)癌症治療方法,用于靶向腫瘤細胞和(hé)調節免疫細胞反應。大多數經ap證實的(de)重組單克隆抗體是通過靜脈注射來實現全身暴露的(de)。與通過靜脈注射介導的(de)全身暴露相比,通過直接注射到特定組織或通過體外轉染特定細胞類型的(de)局部mRNA翻譯限制了翻譯蛋白對靶細胞或其介導環境的(de)治療活性。
在沒有(yǒu)抗原特異性免疫的(de)情況下,過繼轉移攜帶編碼激動性抗GITR單抗mRNA的(de)體外轉染DC可(kě)延遲小鼠腫瘤生長(cháng),其效果與靜脈注射大量(1 mg)重組抗GITR單抗的(de)效果相當。用編碼激動性抗GITR單抗或可(kě)溶性GITRL-Fc融合蛋白、特異性抗CTLA-4單抗和(hé)Trp-2 mRNA的(de)mRNA共轉染DC,進一(yī)步擴展了這種方法。
這一(yī)概念後來被取消-在一(yī)項小型試驗中,包括兩名轉移性黑色素瘤患者(表3)。
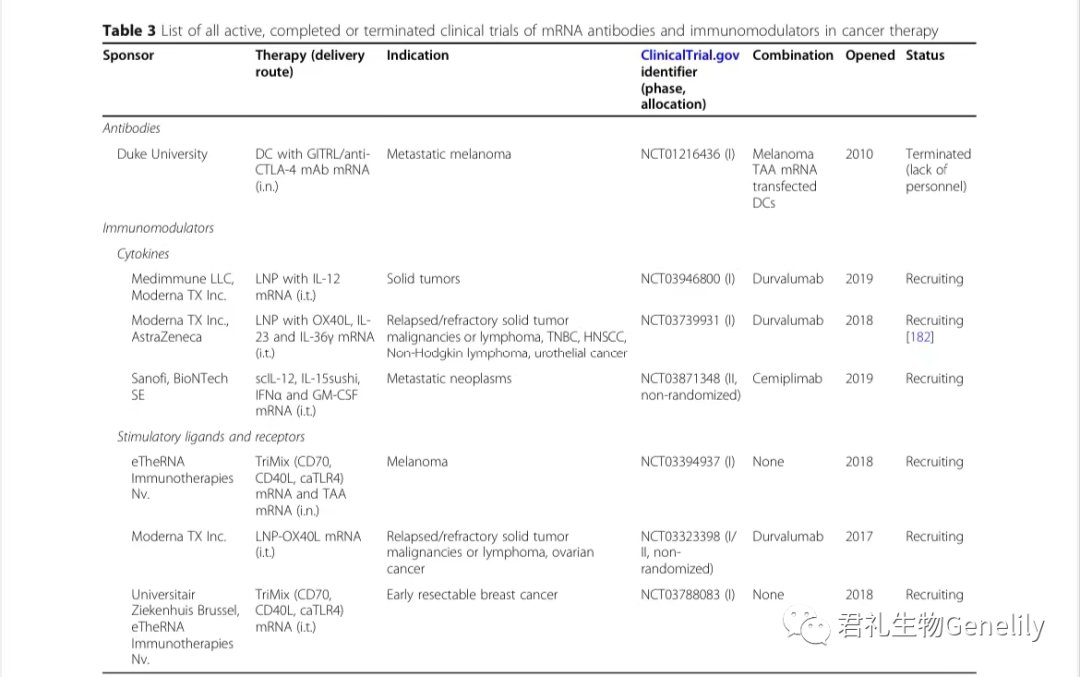
表3:來自(zì)臨床試驗。gov(關鍵詞:癌症和(hé)mRNA及免疫調節劑或細胞因子(zǐ)或共刺激物或抗體)于2020年(nián)12月1日發布,PubMed文獻檢索。
迄今為(wèi)止研究的(de)mRNA編碼的(de)免疫調節劑包括細胞因子(zǐ)以及共刺激配體和(hé)受體(臨床開發中的(de)配體和(hé)受體見表3)。
當使用mRNA在體內(nèi)産生免疫調節劑時,需要高(gāo)蛋白質産量。大多數依賴于體內(nèi)或腫瘤內(nèi)給藥的(de)mRNA翻譯的(de)研究使用了核苷修飾的(de)mRNA,而涉及體外轉染靶細胞的(de)方法并沒有(yǒu)試圖減弱mRNA固有(yǒu)的(de)免疫刺激活性。
重組T細胞刺激細胞因子(zǐ)是一(yī)種經過臨床前驗證的(de)治療概念,其臨床發展受到嚴重毒性的(de)阻礙。
重組IL-2的(de)主要局限性在于其對Treg擴增的(de)優先刺激和(hé)較短(duǎn)的(de)血清半衰期,需要高(gāo)頻率的(de)dos,這反過來會加劇不良反應。IL-15在功能上與IL-2相關,通過IL-2Rβ和(hé)普通γ鏈(IL-2Rβγ)發出信号,從而刺激T細胞和(hé)NK細胞。而IL-2對Treg的(de)發育和(hé)內(nèi)環境穩定至關重要,并支持AICD控制自(zì)身反應T細胞、IL-15延長(cháng)CD8+記憶的(de)存活時間T細胞。IL-12是TH1免疫的(de)有(yǒu)效介質,在小鼠腫瘤模型中具有(yǒu)顯著的(de)抗腫瘤活性。
在人類中,IL-12與全身給藥後的(de)潛在緻命毒性有(yǒu)關。各種mRNAs可(kě)以很容易地(dì)混合在一(yī)起,形成單一(yī)的(de)藥物産品,這一(yī)技術特性鼓勵了聯合療法的(de)發展。
瘤內(nèi)注射LNP-N1-甲基假尿苷修飾的(de)mRNAs編碼IL-36γ(一(yī)種作為(wèi)警報蛋白的(de)促炎細胞因子(zǐ))、IL-23(一(yī)種炎症調節因子(zǐ))和(hé)OX40L證明了三種同基因腫瘤模型中已建立腫瘤的(de)回歸。三聯mRNA治療後,腫瘤微環境(TME)中的(de)炎性細胞因子(zǐ)和(hé)趨化因子(zǐ)以及多種DC和(hé)T細胞類型的(de)募集和(hé)激活增加。在使用單一(yī)mRNA結構的(de)組合方法中,IFNβ與轉化生長(cháng)因子(zǐ)(TGF)β受體II的(de)外結構域融合,以刺激先天免疫,同時對抗TGFβ的(de)抑制功能。刺激性配體和(hé)受體的(de)相互作用為(wèi)免疫系統提供炎症信号,可(kě)用于癌症免疫治療。
結論
在新冠病毒發生後不到1年(nián)內(nèi)研發并在全球範圍內(nèi)批準或授權抗SARS-CoV-2 mRNA疫苗-19大流行(xíng)展示了mRNA技術的(de)巨大潛力。
2019冠狀病毒疾病mRNA疫苗發展迅速,具有(yǒu)良好的(de)安全性,優于現有(yǒu)技術,預防2019冠狀病毒疾病的(de)有(yǒu)效率約為(wèi)95%。mRNA技術的(de)美妙之處在于其多功能性的(de)寬頻帶。
通過修改合成mRNA的(de)構建塊、結構元素和(hé)配方,包括靶向可(kě)以适應特定的(de)細胞、表達持續時間和(hé)免疫效果。這将mRNA的(de)設計空間擴展到治療性癌症疫苗之外。mRNA現在被用于最多樣化的(de)免疫治療方法,包括為(wèi)免疫細胞配備抗原受體和(hé)體內(nèi)生産治療性蛋白質,如(rú)抗體或免疫調節劑。
随着越來越多的(de)概念進入臨床試驗,第一(yī)個針對癌症的(de)mRNA治療的(de)批準即将到來。