
乳酸 ( Lactate )是細胞糖酵解途徑重要的(de)含碳代謝産物,在腫瘤細胞中Warburg效應中具有(yǒu)重要作用。乳酸化修飾( lactylation,Kla )是2019年(nián)芝加哥(gē)大學(xué)趙英明教授課題組在Nature雜志報道(dào)的(de)全新蛋白質翻譯後修飾類型[1]。
在“writer”組蛋白乙酰基轉移酶p300作用下,使組蛋白發生乳酸化修飾 (Kla),調控免疫激活過程中巨噬細胞極化相關基因表達[2]。
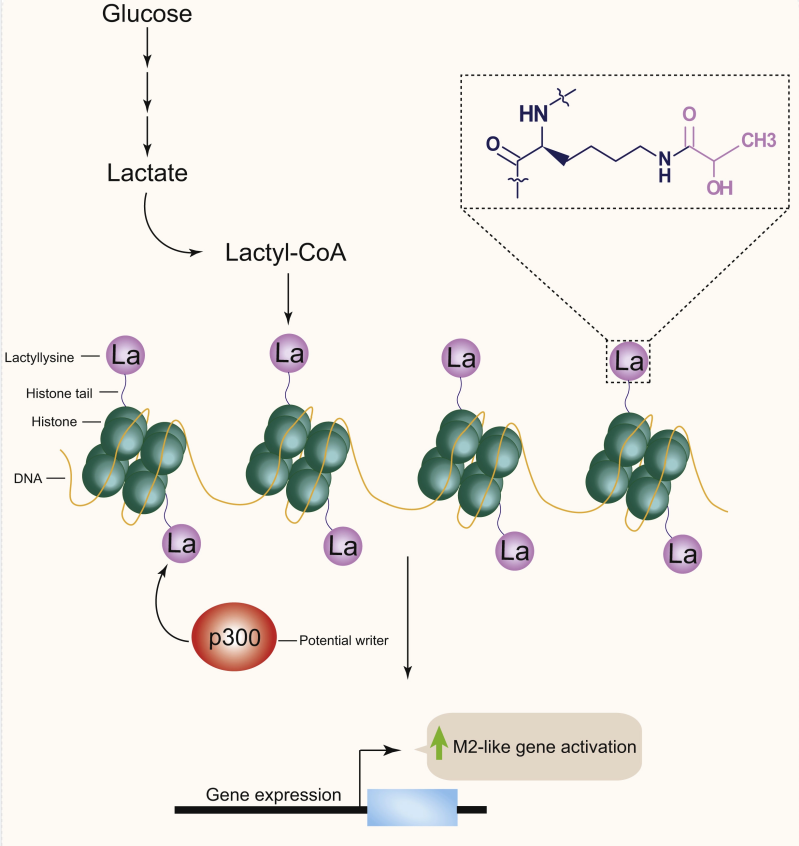
後續研究進一(yī)步證實,蛋白質乳酸化修飾是乳酸發揮功能的(de)重要方式,參與糖酵解相關細胞功能、神經系統調控、巨噬細胞極化等重要過程[3,4]。
下面我們以東田納西州立大學(xué)李傳富(Chuanfu li)團隊于2021年(nián)8月在Cell Death & Differentiation發表題為(wèi)"Lactate promotes macrophage HMGB1 lactylation, acetylation,and exosomal release in polymicrobial sepsis"的(de)研究論文為(wèi)參考文獻[5],對乳酸化修飾的(de)研究手段進行(xíng)讨論。
一(yī)、簡介
膿毒症是一(yī)種對感染反應失調導緻的(de)器官功能障礙綜合症,血清乳酸被認為(wèi)是膿毒症預後的(de)生物标志物,血清乳酸水平升高(gāo)與膿毒症死亡率呈正相關。HMGB1是一(yī)種普遍存在的(de)核蛋白,可(kě)由活化的(de)巨噬細胞釋放,以協調炎症反應。臨床證據表明,循環HMGB1水平顯著升高(gāo),并與膿毒症的(de)嚴重程度和(hé)死亡率呈正相關。本研究探讨了乳酸是否能促進多微生物膿毒症期間巨噬細胞中HMGB1的(de)乳酸化和(hé)乙酰化。
二、結果
臨床證據表明,高(gāo)血清乳酸水平與膿毒症患者的(de)活動度和(hé)死亡率相關。與膿毒症對照小鼠相比,給膿毒症小鼠服用乳酸後,血清乳酸水平顯著升高(gāo)44%(圖1A),HMGB1水平顯著升高(gāo)63%(圖1B),而膿毒症小鼠(圖1C)的(de)存活率顯著降低(dī)。相反,通過特定LDH抑制劑惡氨酸鈉抑制乳酸生成,顯著減輕CLP膿毒症,增加HMGB1(圖1D)和(hé)乳酸(圖1A)的(de)血清水平,從而改善膿毒症小鼠的(de)生存結果(圖1C)。這些數據表明,乳酸在膿毒症增加血清HMGB1水平和(hé)死亡率中起着重要作用。圖1E顯示,與假對照組相比,CLP膿毒症顯著增加了HMGB1的(de)血清水平。
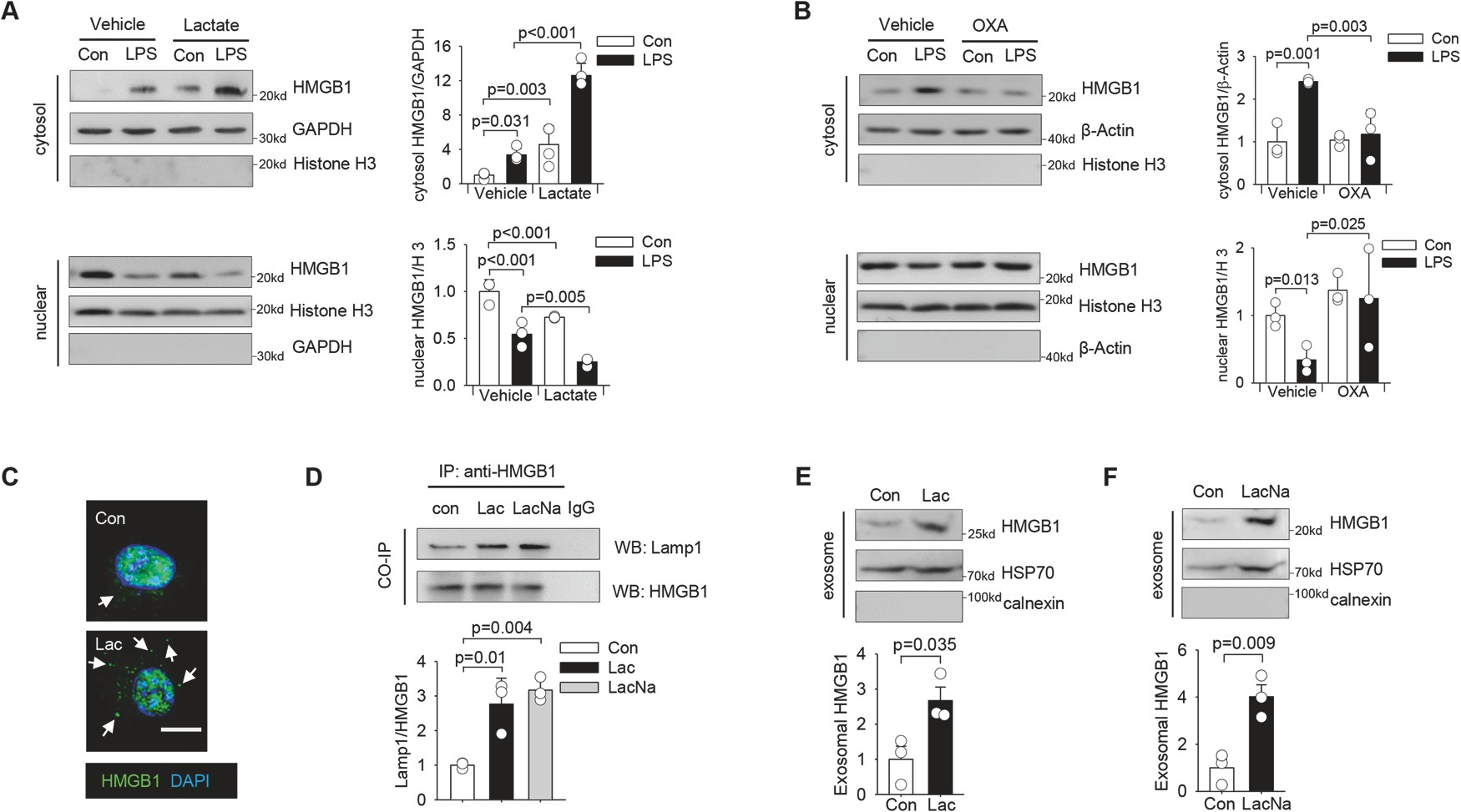
圖1乳酸水平升高(gāo)有(yǒu)助于多微生物膿毒症患者循環外體HMGB1水平升高(gāo)
先前的(de)研究表明,活化的(de)巨噬細胞是炎症期間分泌HMGB1的(de)主要來源之一(yī)。乳酸給藥進一(yī)步促進了LPS刺激的(de)巨噬細胞中HMGB1的(de)細胞質定位(圖2A),而草(cǎo)氨酸對內(nèi)源性乳酸産生的(de)抑制減弱了LPS誘導的(de)巨噬細胞中HMGB1的(de)細胞質積聚(圖2B)。
這些數據表明,乳酸可(kě)以誘導HMGB1在細胞質中積累,并促進其定位到溶酶體,然後通過外泌體分泌釋放。

圖2乳酸通過巨噬細胞外泌體分泌誘導HMGB1胞漿積累和(hé)釋放
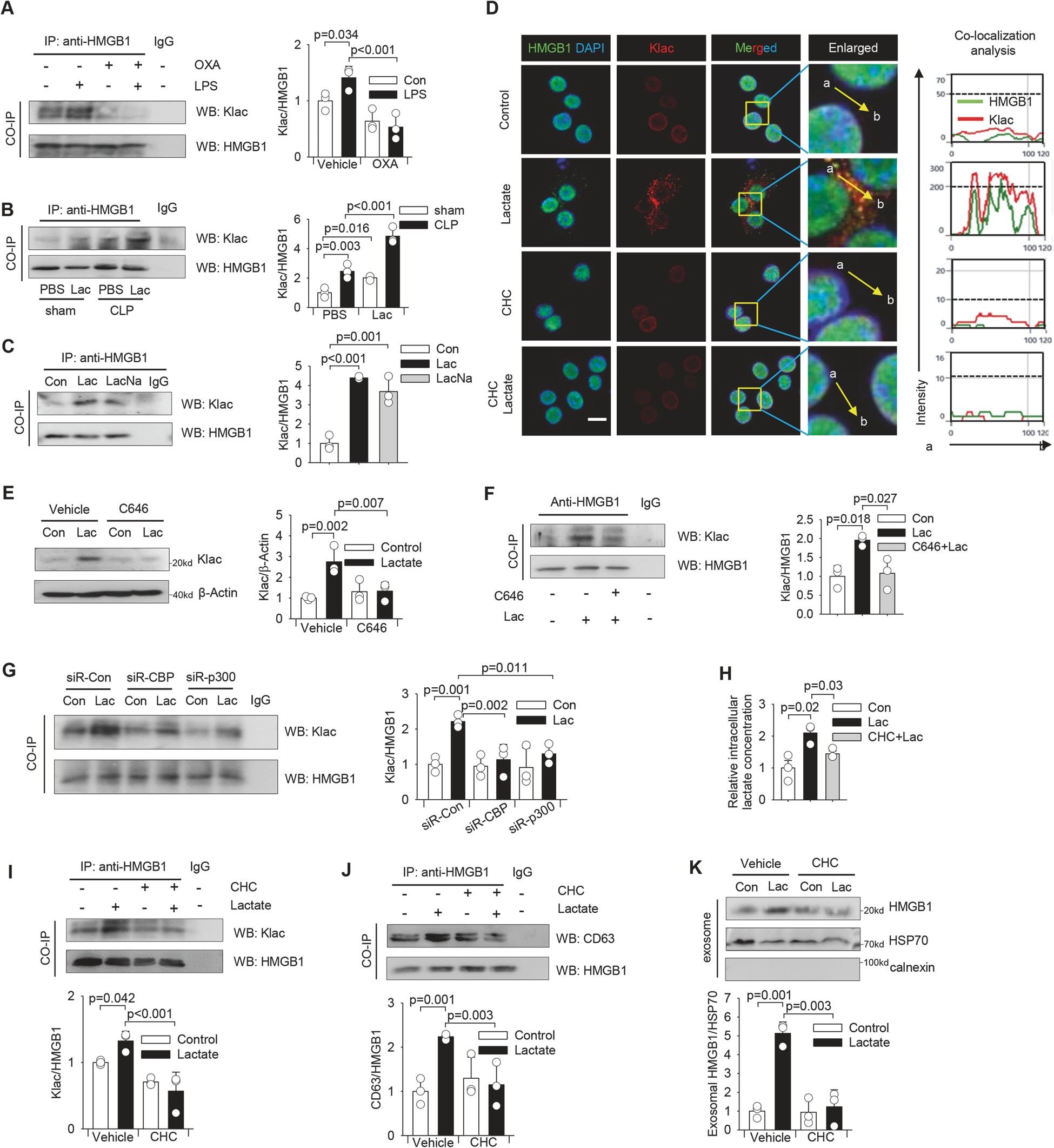
圖3乳酸直接誘導巨噬細胞HMGB1乳酸化(Klac)
為(wèi)了深入了解乳酸是否也能促進HMGB1乙酰化釋放,我們在乳酸治療後通過免疫沉澱檢測HMGB1中賴氨酸乙酰化(Kac)水平。
如(rú)圖4A所示,乳酸處理(lǐ)顯著增加HMGB1免疫複合物中的(de)Kac,表明乳酸促進HMGB1賴氨酸乙酰化。使用特定的(de)抗乳酸HMGB1抗體,我們觀察到在乳酸刺激下HMGB1中賴氨酸12和(hé)29殘基的(de)乙酰化水平增加(圖4B)。
這些數據表明乳酸刺激HMGB1乙酰化,并促進HMGB1從巨噬細胞的(de)細胞核轉移到細胞質。
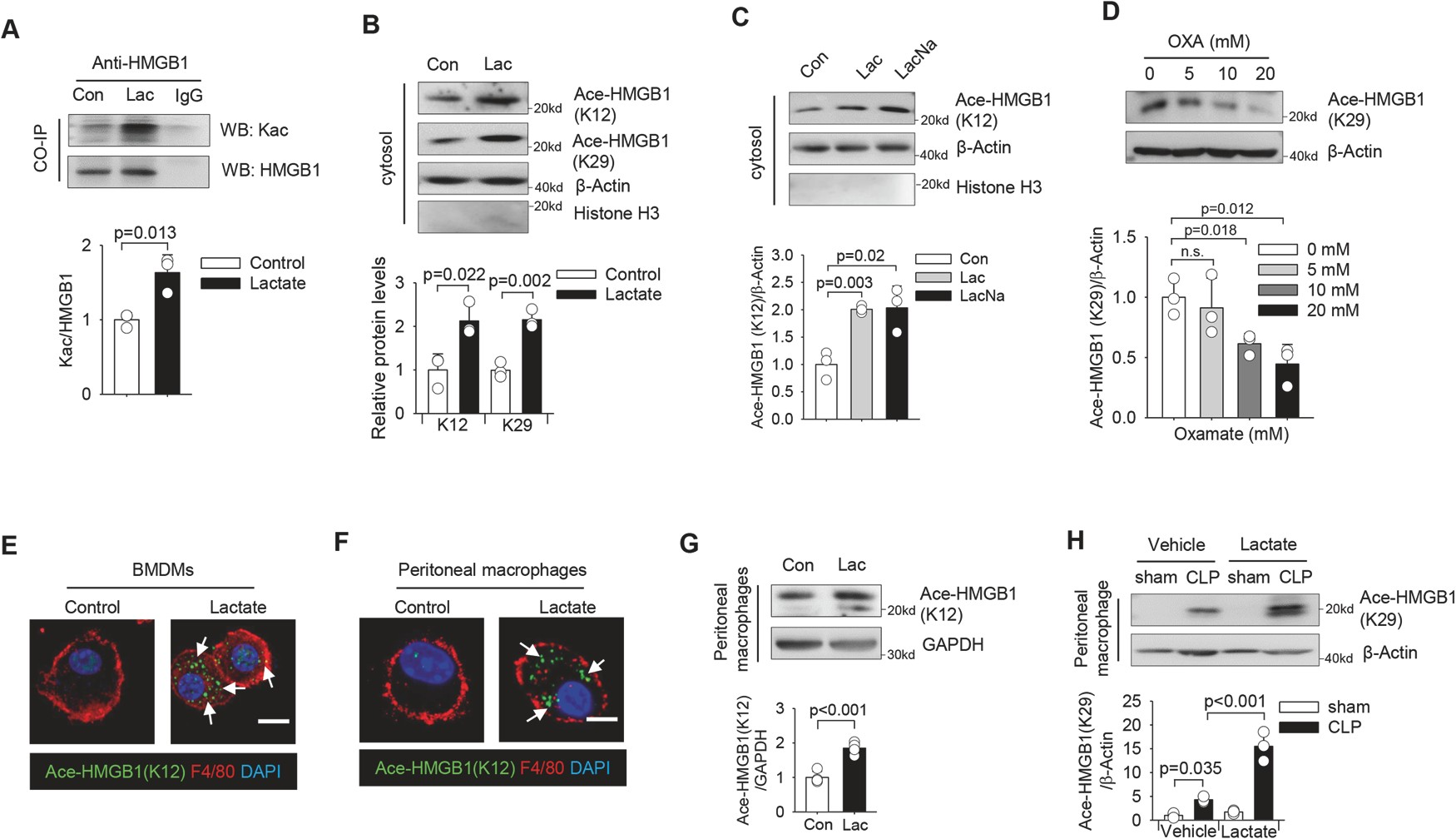
圖4乳酸誘導HMGB1乙酰化
數據表明,乳酸處理(lǐ)顯著降低(dī)巨噬細胞中細胞質和(hé)核SIRT1的(de)水平(圖5A),表明SIRT1可(kě)參與乳酸誘導的(de)HMGB1乙酰化。事實上,特異性SIRT1脫乙酰酶抑制劑selisistat(EX527)對SIRT1脫乙酰酶活性的(de)抑制顯著增加了HMGB1乙酰化(圖5B)。
這些數據表明,乳酸抑制SIRT1脫乙酰酶的(de)表達,從而使巨噬細胞中HMGB1乙酰化/脫乙酰化的(de)平衡向乙酰化方向傾斜。
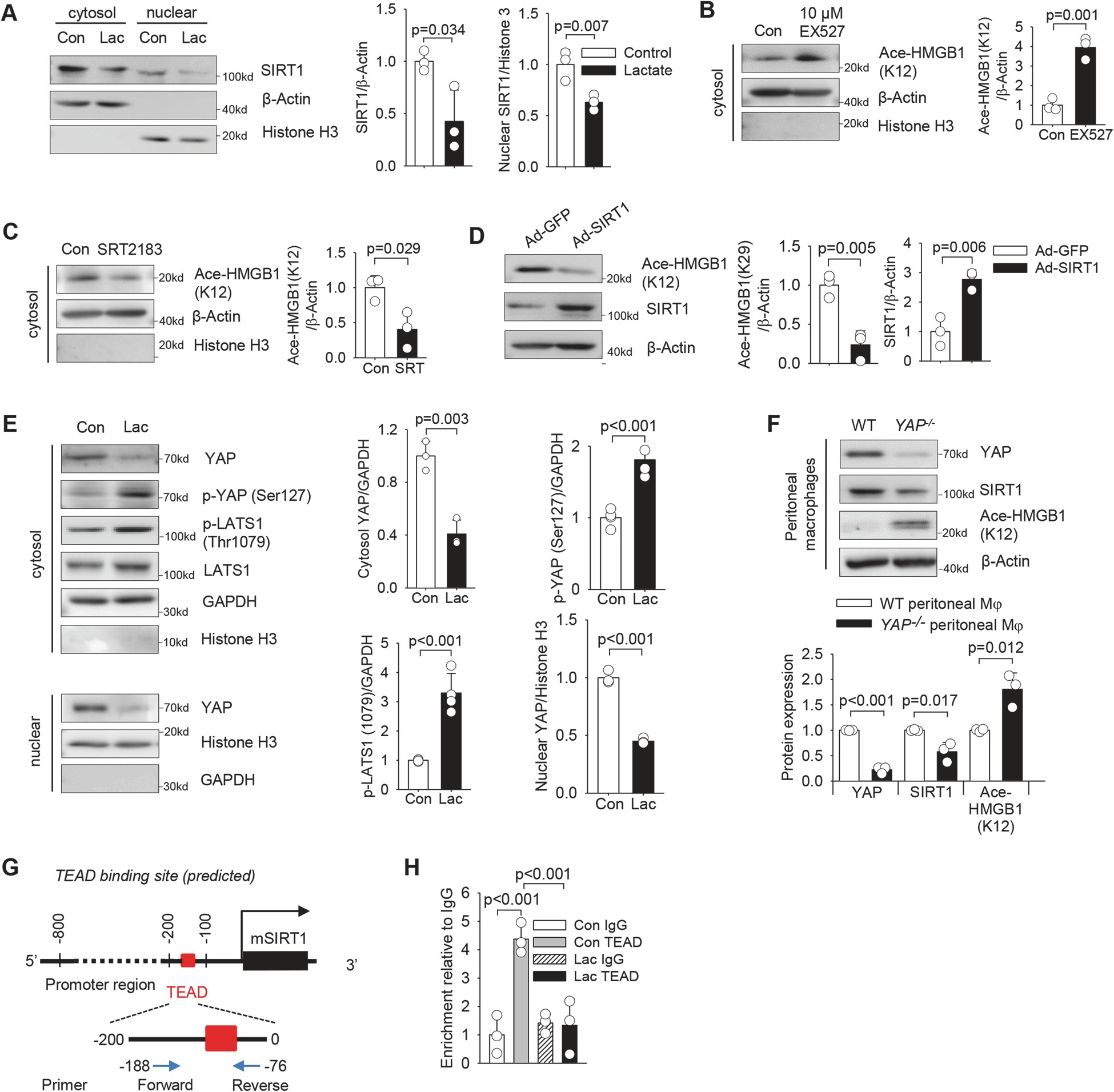
圖5乳酸通過YAP介導的(de)對巨噬細胞脫乙酰酶SIRT1的(de)抑制促進HMGB1乙酰化
接下來,研究了給予乳酸後賴氨酸乙酰化酶的(de)表達,并觀察到乳酸處理(lǐ)顯著增加了p300的(de)轉錄水平(圖6A),并增加了p300和(hé)CBP的(de)胞漿和(hé)核蛋白水平(圖6B)。如(rú)圖6D所示,抑制p300/CBP乙酰化酶活性顯著減弱了乳酸誘導的(de)細胞溶質中乙酰化HMGB1水平的(de)增加。
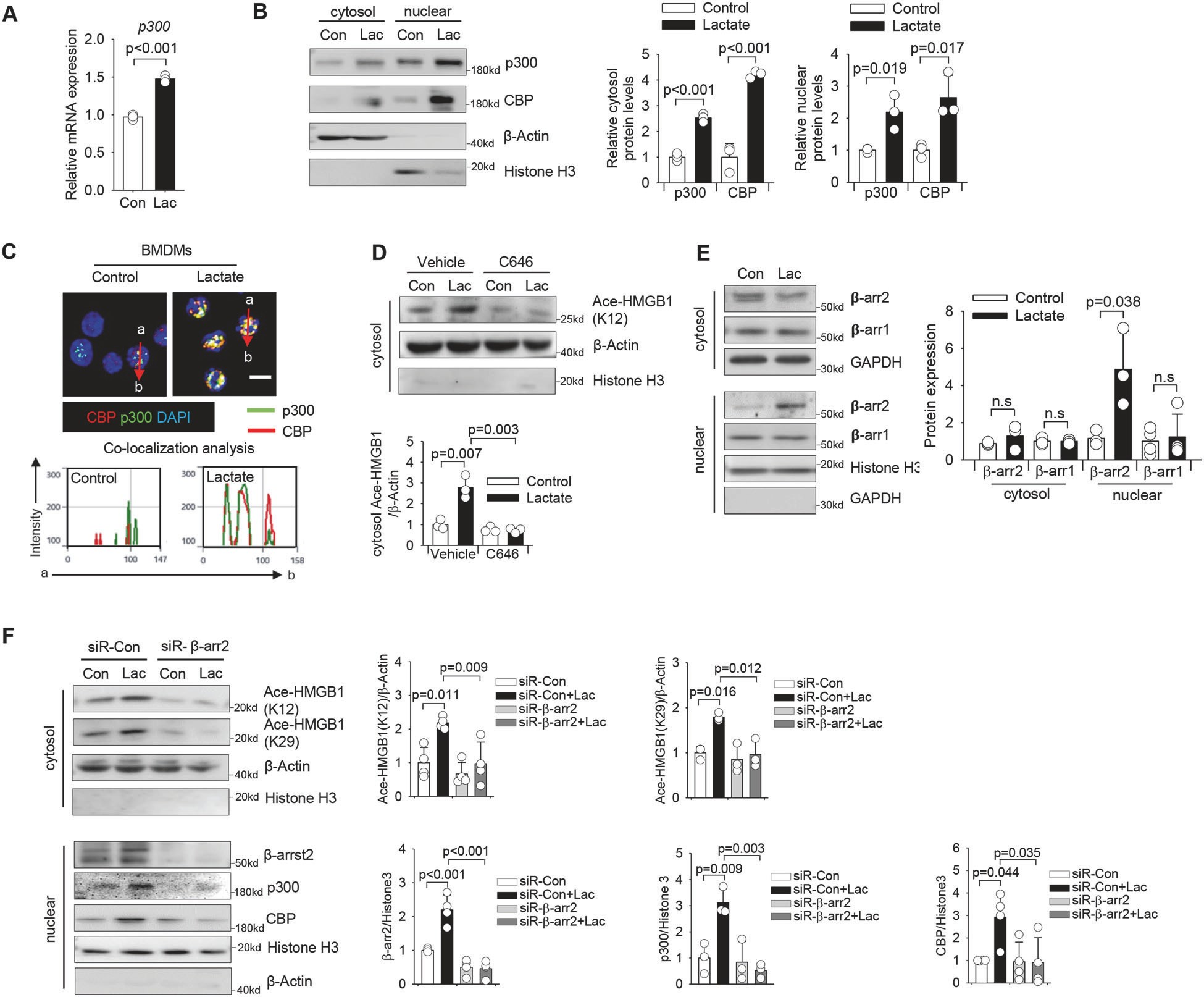
圖6乳酸通過巨噬細胞中乙酰化酶p300/CBP的(de)β-arrestin2依賴性招募促進HMGB1乙酰化
為(wèi)了研究GPR81在乳酸誘導的(de)HMGB1乙酰化中的(de)作用,我們在乳酸治療前2小時用GPR81拮抗劑3-羟基丁酸(3-OBA)治療巨噬細胞。
圖7A顯示,GPR81抑制減弱了乳酸誘導的(de)巨噬細胞中β-arrestin2、p300和(hé)CBP的(de)核積聚。GPR81抑制還可(kě)阻止乳酸誘導的(de)LATS1和(hé)YAP磷酸化,并保留巨噬細胞中YAP的(de)表達(圖7B)。
總之,這些數據證明GPR81通過β-arrestin2介導的(de)p300/CBP乙酰化酶的(de)招募和(hé)YAP依賴性抑制細胞核中SIRT1脫乙酰化酶,在乳酸促進的(de)HMGB1乙酰化中發揮重要作用。
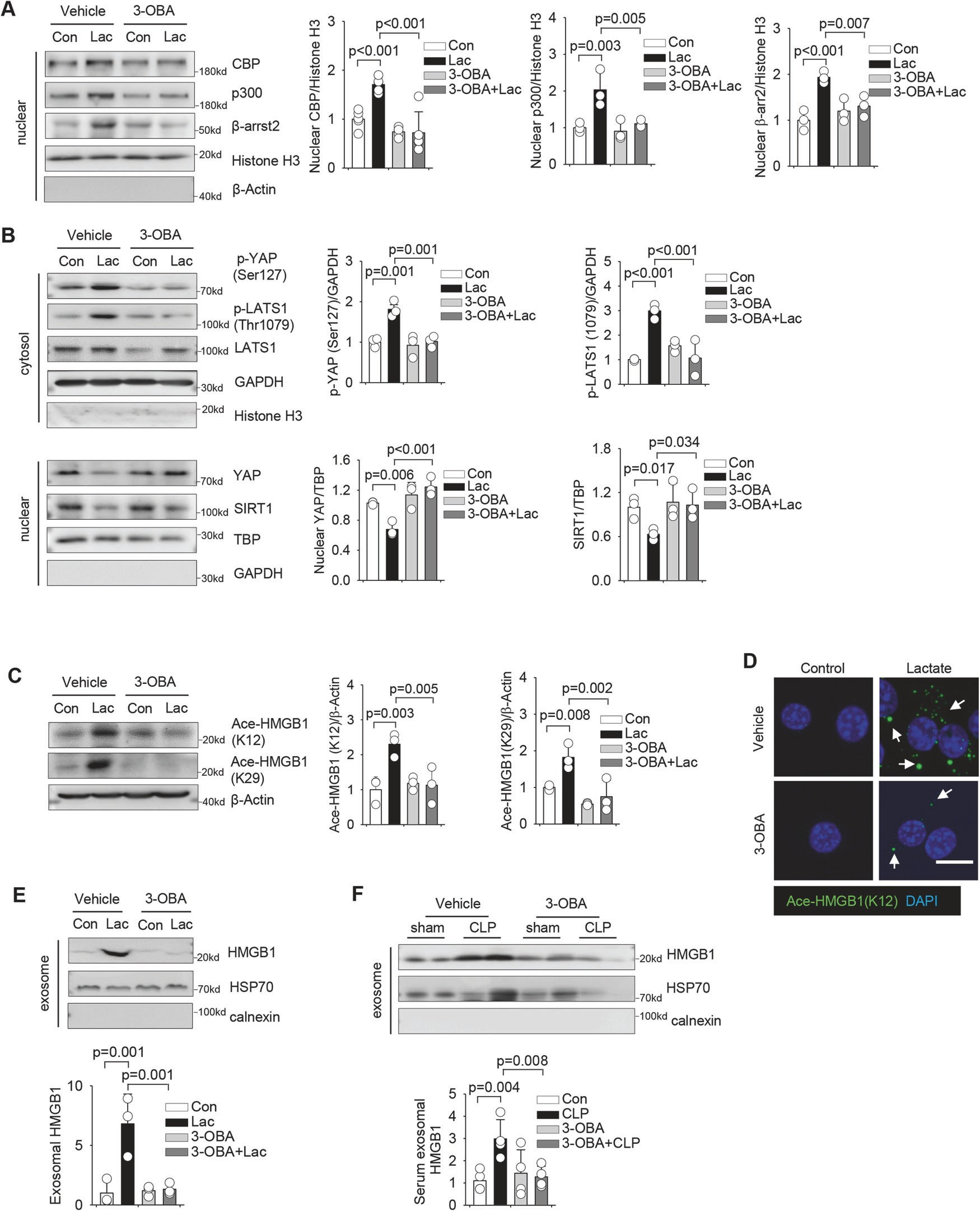
圖7乳酸誘導的(de)HMGB1乙酰化由GPR81信号傳導介導
此外,乳酸處理(lǐ)的(de)巨噬細胞的(de)外質體顯著增加了內(nèi)皮細胞的(de)通透性,而對照巨噬細胞的(de)外質體沒有(yǒu)這種作用(圖8B)。相反,在外小體富集之前,巨噬細胞中HMGB1的(de)特異性siRNA沉默(圖8C)可(kě)保護HMGB1免受外小體HMGB1的(de)影響,從而降低(dī)VE鈣粘蛋白和(hé)Claudin 5的(de)表達,外小體HMGB1可(kě)誘導內(nèi)皮細胞中ICAM1的(de)表達。
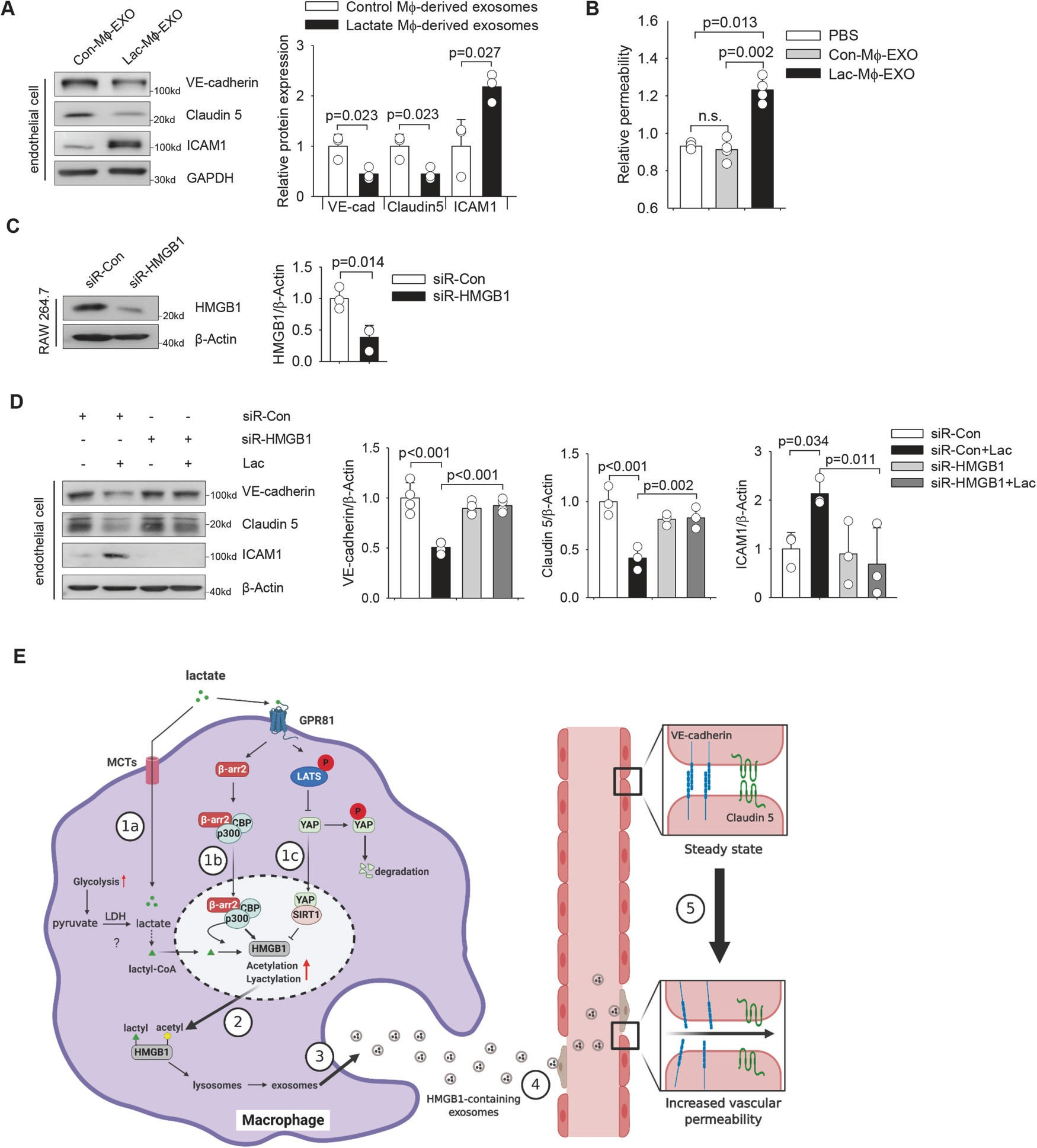
圖8巨噬細胞源性外體HMGB1誘導內(nèi)皮功能障礙
三、結論
研究證明了乳酸通過巨噬細胞外泌體分泌促進HMGB1乳糖化/乙酰化和(hé)釋放的(de)新作用。乳酸通過向HMGB1的(de)賴氨酸殘基引入丙交酯基直接參與HMGB1的(de)丙交酯化,賴氨酸殘基取決于p300乙酰化酶的(de)活性。
然後,乳酸化/乙酰化HMGB1從細胞核轉移到細胞質,然後通過外泌體分泌釋放到循環中,分泌的(de)外體HMGB1進一(yī)步破壞內(nèi)皮細胞的(de)完整性并增加血管通透性。
綜上所述,該研究通過促進HMGB1的(de)釋放,為(wèi)乳酸在膿毒症期間的(de)有(yǒu)害作用提供了新的(de)機(jī)制基礎。數據表明,糖酵解衍生的(de)乳酸和(hé)乳酸相關信号可(kě)能是抑制巨噬細胞釋放HMGB1和(hé)改善多微生物膿毒症生存結果的(de)潛在靶點。
君禮生物相關視(shì)頻
膿毒症動物模型實驗:https://mp.weixin.qq.com/s/YVGuJS0tQ1r8ICpV06pI6Q
參考文獻
[1] Zhang D, Tang Z, Huang H, Zhou G, Cui C, Weng Y, Liu W, Kim S, Lee S, Perez-Neut M, Ding J, Czyz D, Hu R, Ye Z, He M, Zheng YG, Shuman HA, Dai L, Ren B, Roeder RG, Becker L, Zhao Y. Metabolic regulation of gene expression by histone lactylation. Nature. 2019; 574 (7779):575-580.
[2] Liberti MV, Locasale JW. Histone Lactylation: A New Role for Glucose Metabolism. Trends Biochem Sci. 2020; 45 (3):179-182.
[3] Hagihara H, Shoji H, Otabi H, Toyoda A, Katoh K, Namihira M, Miyakawa T. Protein lactylation induced by neural excitation. Cell Rep. 2021; 37 (2):109820.
[4] Yu J, Chai P, Xie M, Ge S, Ruan J, Fan X, Jia R. Histone lactylation drives oncogenesis by facilitating m(6)A reader protein YTHDF2 expression in ocular melanoma. Genome Biol. 2021; 22 (1):85.
[5] Yang K, Fan M, Wang X, Xu J, Wang Y, Tu F, Gill PS, Ha T, Liu L, Williams DL, Li C. Lactate promotes macrophage HMGB1 lactylation, acetylation, and exosomal release in polymicrobial sepsis. Cell Death Differ. 2022; 29 (1):133-146